- 网页首站
- 企业展示
- 产品中心
- 新闻动态
- 合作伙伴
- 招贤纳士
- 联系我们
QuantSeq 3'mRNA-Seq Library Prep Kit是以mRNA的3’端序列进行文库构建,文库可兼容Illumina和Ion Torrent测序平台。每个转录本只产生一个片段,因此能准确进行基因表达定量,同时减少测序深度及更多样本混样测序。
优势
快速简单的一体化实验方案: 从总RNA到可用于测序的文库时间不超过4.5小时;
每个转录本只产生一个片段—可对基因表达精确定量;
能稳定、灵敏检测低丰度的转录本;
适用于低起始量(10ng)及低质量RNA(如FFPE样本)
可高效替代芯片检测或传统的RNA测序,友好匹配自动化工作站
在Blubee基因组分析平台上免费进行数据分析
Quantseq 表达谱建库试剂盒能大幅度降低成本以及简便地去除Globin mRNA
超强版dual indexes能支持9,216个 i5/i7 index组合,或者可选择384种unique index,同时提供能够检测、排除扩增偏好性的UMIs
建库流程
QuantSeq 3'mRNA-Seq Library Prep Kit通过oligo dT引物特异逆转录poly(A)尾3’ mRNA,第二链使用随机引物进行合成。由于插入片段的大小是由第二链合成引物和poly(A)尾之间的距离决定的,因此无需额外进行 RNA 片段化。随后的PCR可以提供9,216个不同的i5/i7index组合用于Illumina平台,48个index 用于Ion Torrent平台。能够实现更多样本混样测序。QuantSeq Reverse (REV)包含定制的测序引物(CSP),可覆盖Poly A尾结构,从而提高Read 1的数据质量。此外,REV获得的序列即为3'端序列,因此,可对3’UTR以及多聚腺苷酸(APA)位点进行准确分析。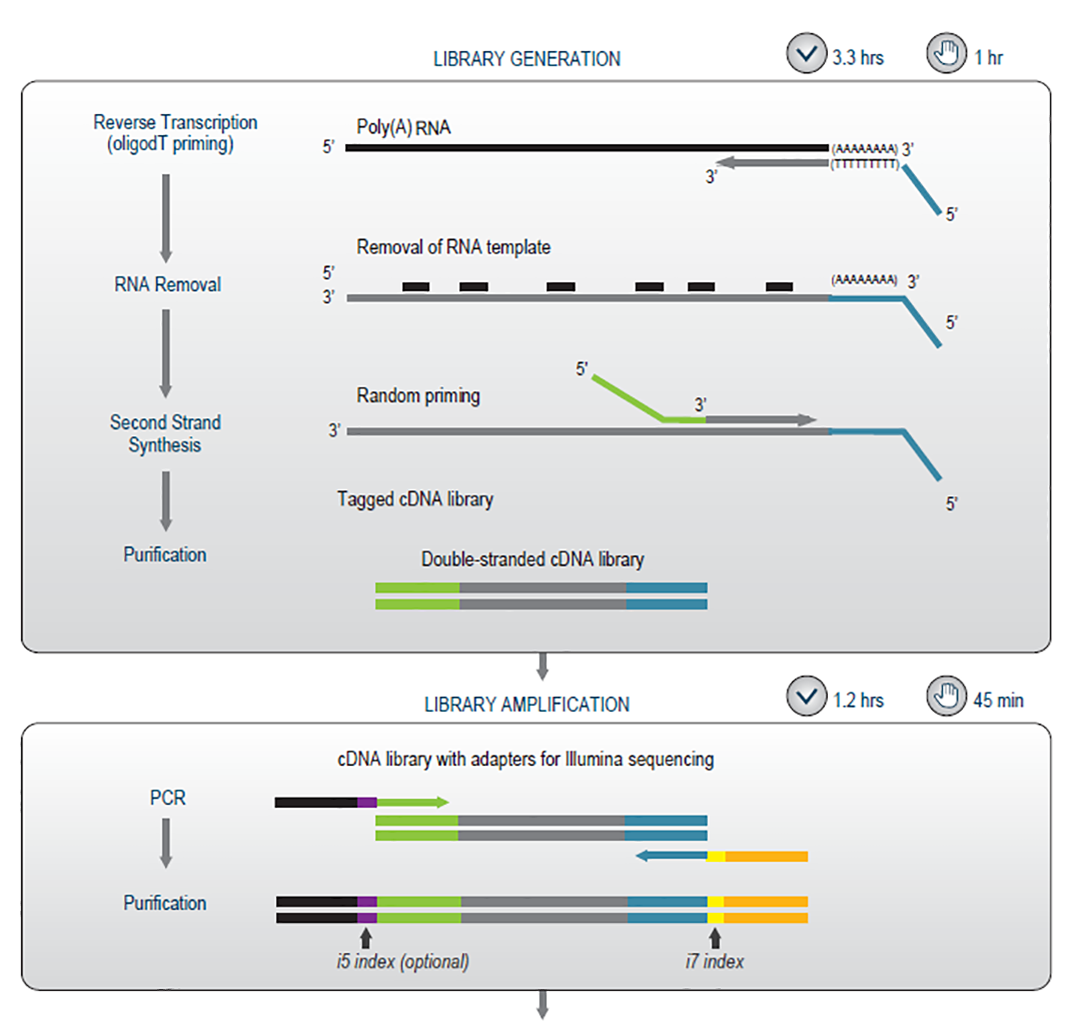

真核生物基因表达的特点是受多种调控网络共同调控,受转录、RNA加工处理及降解等环节所调控。这种复合调控网络的变化可能为塑造特定细胞类型的转录组提供重要手段。在真核生物中,大多数的mRNA前体(pre-mRNA)通过在5'端添加一个7-甲基鸟苷的帽子结构,切除内含子以及3'-末端切割和聚腺苷酸化(Poly A)的修饰从而得到成熟的mRNA。这是一个非常精密的调控过程,异常的RNA种类可被特殊的质量控制机制降解掉。所有这些事件都可以协同转录发生,从接收延长RNA聚合酶II (Pol II)的调节信号,到通过各种形式的功能反馈来调节RNA合成的效率。
由Pol II转录而来的转录本先加帽子结构,随后是核帽结合复合体(CBC)的组装,为RNA合成和随后的加工事件之间提供了一条关键的通信线路。CBC的两个核心亚基,Ncbp1/Cbc80和Ncbp2/Cbc20,可以招募多个额外的辅因子,包括保守的多用途接头蛋白Srrt/Ars2。Srrt已被证明以外泌体依赖的方式介导启动子-近端转录本的降解,促进复制依赖组蛋白mRNA和其他Pol II转录本的终止/3-末端成熟,并控制小的非编码RNAs的产生。值得注意的是,CBC可以通过招募U1snRNP和剪接体复合物的其他组分到cap-近端内含子来刺激pre-mRNA的剪接,但这一活性是否依赖于Srrt仍是一个悬而未决的问题。
与在不同条件下可稳定表达的核心CBC组分不同,Srrt往往在增殖细胞中比在分化或静止的细胞中更丰富。与这种行为相一致的是,Srrt已被证明在体内和体外都能促进哺乳动物细胞的增殖。这些作用可能是由Srrt的microRNA或/和组蛋白mRNA调控活性促进的。另一方面,Srrt通过促进关键转录因子Sox2的表达,以一种microRNA非依赖性方式促进小鼠神经干细胞(NSCs)的维持。此外,Srrt对于脊椎动物的早期发育至关重要。然而,这种效应背后的分子机制仍然知之甚少。
mRNA前体切割和聚腺苷酸化是基因调控的另一个关键环节。这两个耦合反应涉及多亚基蛋白质复合体在一个6-nt聚腺苷酸化信号(PAS)及其相邻序列的共转录组装,新转录本在切割/聚腺苷酸化位点(CS)的切割,通常位于PAS的下游10- 30 nt,随后在新形成的3端添加poly(a)尾。协同转录切割/聚腺苷酸化触发PolII延申复合体从DNA模板上快速释放。
有趣的是,U1snRNP被招募到5’端的剪接位点(5ss)或其他同源motifs可以通过一种剪接非依赖性的机制抑制下游的CSs,称为远端抑制(telescripting)。相对较长的哺乳动物基因的正常表达需要远端抑制(Telescripting),其效率可通过细胞转录活性的整体变化(改变游离U1和mRNA前相关U1之间的比例)来调节。然而,还不清楚telescripting是否可以以一种更细微的特定细胞类型的方式进行控制。同样,telescripting和Pol II伸长的早期步骤之间出现的联系有待进一步的实验表征。
胚胎干细胞(ESCs)是发育早期的祖细胞,能够自我更新并分化成胚胎的三个胚层。我们知道,包括Pou5f1/Oct4、Nanog和Sox2在内的几个转录因子在确定多能干细胞的分子特性和其他类型多能干细胞的分子特性方面起着关键作用。
在本文中,作者将Srrt作为参与维持ESC特性的首要候选调节子进行研究。作者发现,Srrt通过抑制第一个内含子切割/聚腺苷酸化位点的转录的过早终止而发挥作用。这种机制影响ESCs中数百个活跃的基因,并由CBC依赖的U1snRNP募集到pre-mRNA5 -近端序列所介导的。除了可能对进化保守的基因调控事件有贡献外,该活性限制了逆转录转座子(RTEs)在其目标基因的第一个内含子中积累的有害影响。总的来说,作者的工作揭示了在ESC生物学中起重要作用的转录组范围的抗终止途径。
ESC的维持依赖于Srrt的自然高表达
Srrt蛋白在小鼠ESCs中很容易检测到,并且在增殖的NSCs[fold change (FC) = 2.9;t检验p= 1.3e-04]和有丝分裂后神经元(FC= 5.8;t检验p= 8.8e-04;图1b) 中其水平显著降低。
为了探讨ESCs中Srrt自然高表达的功能意义,作者用4种Srrt特异性siRNA的混合物将其下调至与在分化细胞中观察到的相当水平(siSrrt;图1c;与图1b相比)。与对照siRNA处理的培养物相比,ESC细胞特有的圆形形态消失,ESC特异性碱性磷酸酶活性降低(siCtrl;图1d)。Srrt敲降也导致了在群落形成试验中容易检测到的分化效应(图1e、f)。这提示ESCs的维持依赖于Srrt的相对高表达。
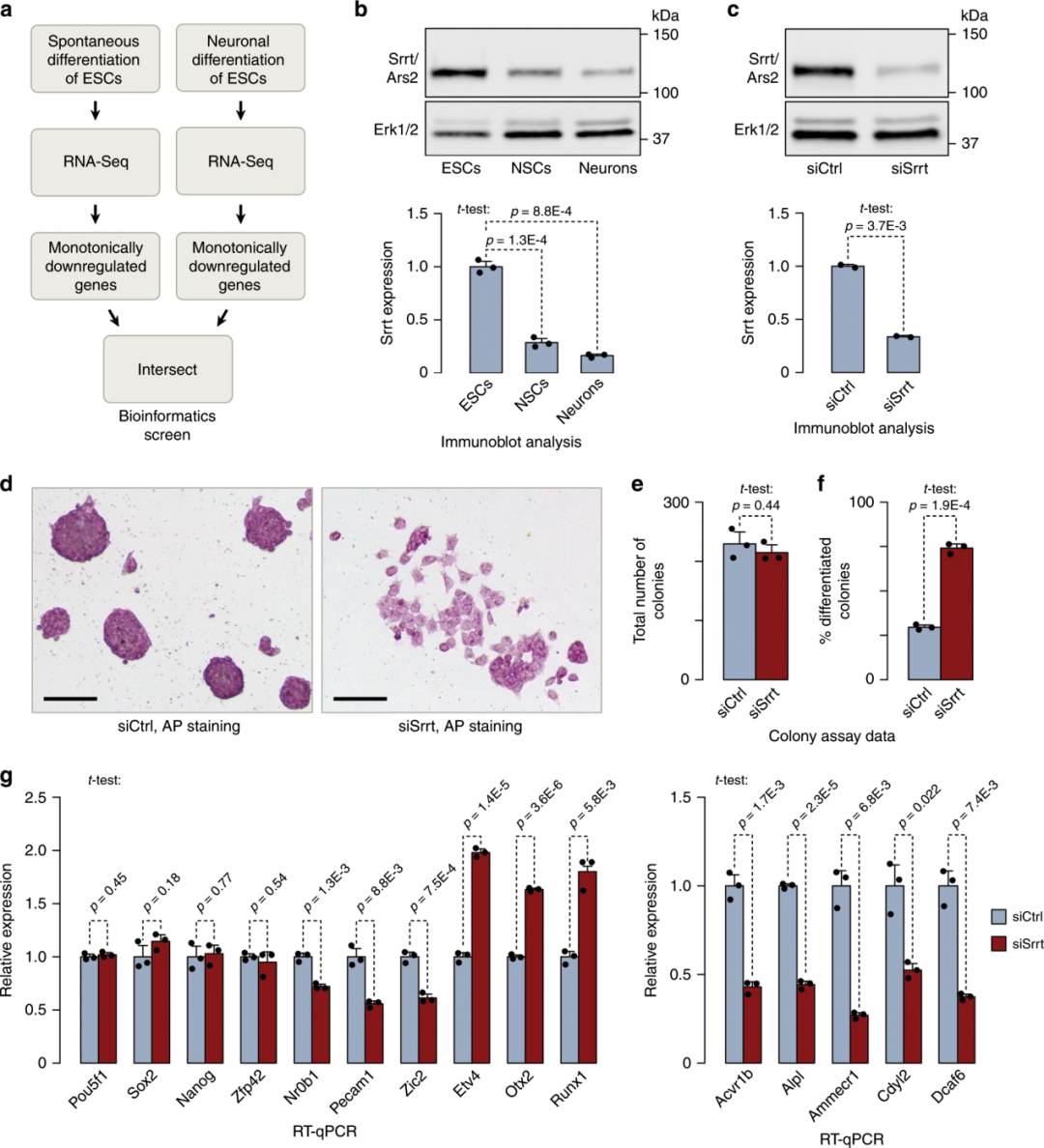
图1:Srrt是鼠标ESC维护所必需的。
Srrt基因敲降对ESC转录组有全局影响
siSrr处理的ESCs的转录组发生了相当大的变化(图2)。被调控的基因与那些在ESCs自发分化过程中改变其表达的基因部分重叠(图 2a)。尽管响应siSrrt,包括Pou5f1 / Oct4,Sox2和Nanog在内的许多多能性标记物的表达均保持不变,但该类别的某些基因(例如Nr0b1,Pecam1和Zic2)被检测到下调(图 2b)。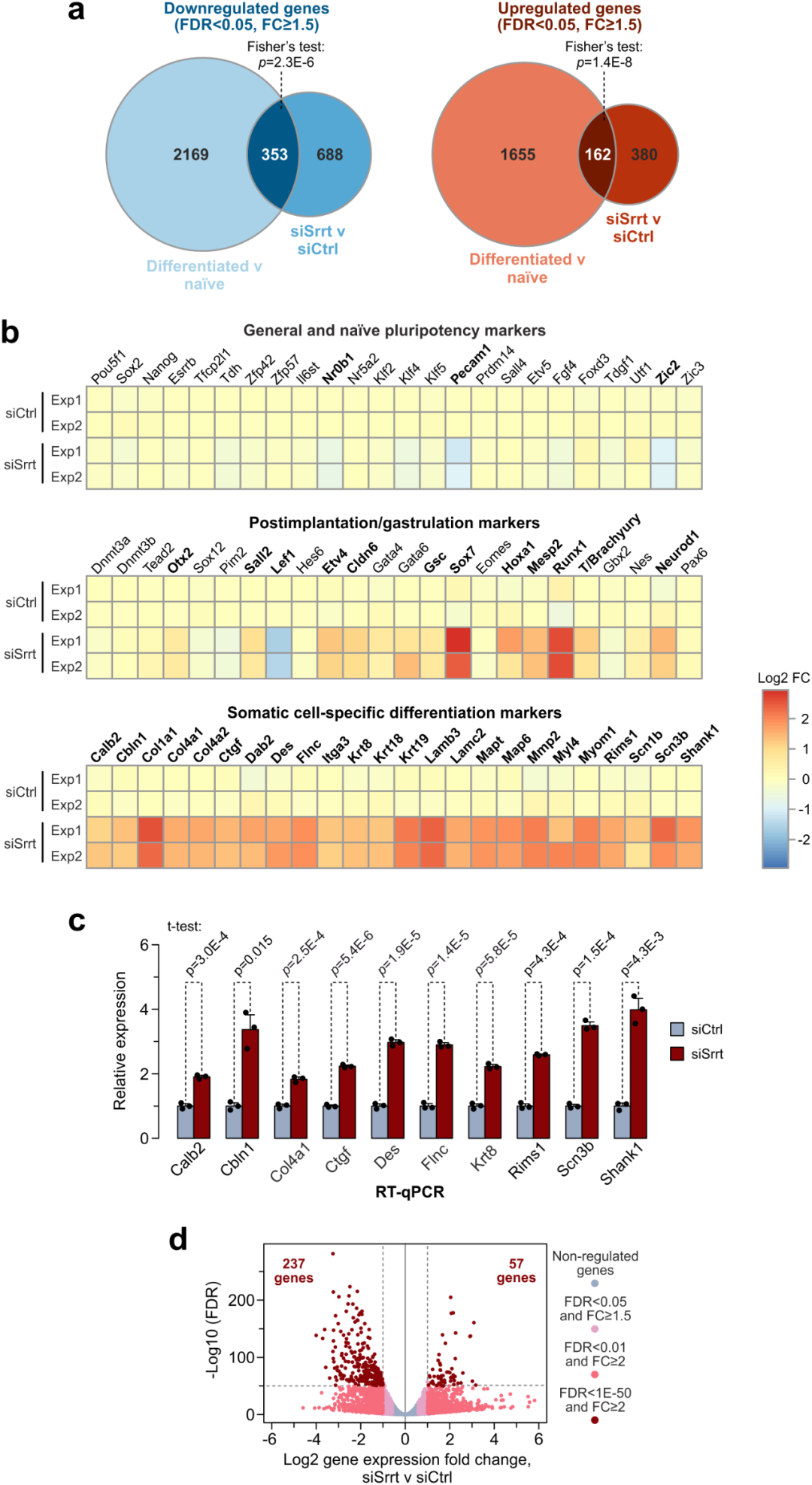
图2. 在ESCs中,Srrt基因的下调引起ESC转录组发生大范围的变化
Srrt限制提前终止的转录本的表达
Srrt敲降后,RNA-Seq发现许多基因的第一(5'-近端)内含子reads数积累增加(图3a)。这与相应基因的下调相吻合(3b中的右下象限和图3c中的蓝线),另外,RNA-Seq显示第一内含子序列的5'端覆盖率显著增加(图3d)。
图3. siSrrt基因表达的影响通常涉及第一内含子的RNA加工变化
为了检查这种行为是否可能是由于转录的过早终止导致的,作者使用3'-端RNA测序(3'RNA-Seq,Lexogen)绘制了切割/聚腺苷酸化位点(CSs)的位置。经过siSrrt处理后,ESC中,第一个内含子内CS的广泛活化(图4a)。在其他内含子中,过早卵裂/聚腺苷酸化的显著变化不太常见,并且缺乏像第一个内含子中观察到的这种上调趋势(图4a)。在第一个内含子中上调的CSs往往发生在相对靠近5 '剪接位点(5 ' ss)的位置。(图4b)。与位于相同基因的3’UTRs中的CSs相比,以前在polyA_DB3数据库注释的这些CS少得多(30.1%对81.4%; Fisher精确检验p =3.9E-179)。然而,在这两个CS类别中,位于其上游的典型切割/PAS AATAAA或其常见变异ATTAAA位点的发生率几乎没有区别。因此,Srrt抑制了以第一内含子中少知的一类CSs为终止点的多个转录本的表达。
Srrt阻断第一个内含子的切割/聚腺苷酸化
两种可能可解释Srrt基因敲除导致转录本提前终止的积累:(1)增强pre-mRNA的剪切和相应内含子位置的聚腺苷酸化;或(2)增强这些相对较短RNA种类的稳定性。前者机制应该会降低全长mRNA异构体的产生,而后者不太可能产生这种效果。值得注意的是,第一内含子中CSs的激活与相应基因表达水平的整体下降以及其3'UTRs中CSs的下调密切相关(图4c)。有284个基因有内含子CS (iCS)上调≥2倍,且表达量降低≥1.5倍,FDR <0.05,如果使用不那么严格的阈值,检测到以上趋势的基因甚至更多(补充材料)。
对于单个基因,RNA-Seq和3'RNA-Seq覆盖图与转录组范围分析一致(图4d)。对Ammecr1, Cdyl2和 Dcaf6这三个基因进行验证,siSrrt增加了iCSs上游的RT-qPCR信号,同时降低了下游RNA序列的丰度(图4e)。
重要的是,当用CRISPR-Cas9删除Ammecr1序列(含强Srrt调控的iCS的两个上游PAS位点)(图5a,b),突变等位基因(ΔPAS)失去了过早裂解的能力且其表达量降低随着Srrt的敲降(图5c-e)。总之,这些数据表明,Srrt通过阻断第一内含子中的过早切割/聚腺苷酸化来促进全长mRNA的表达。
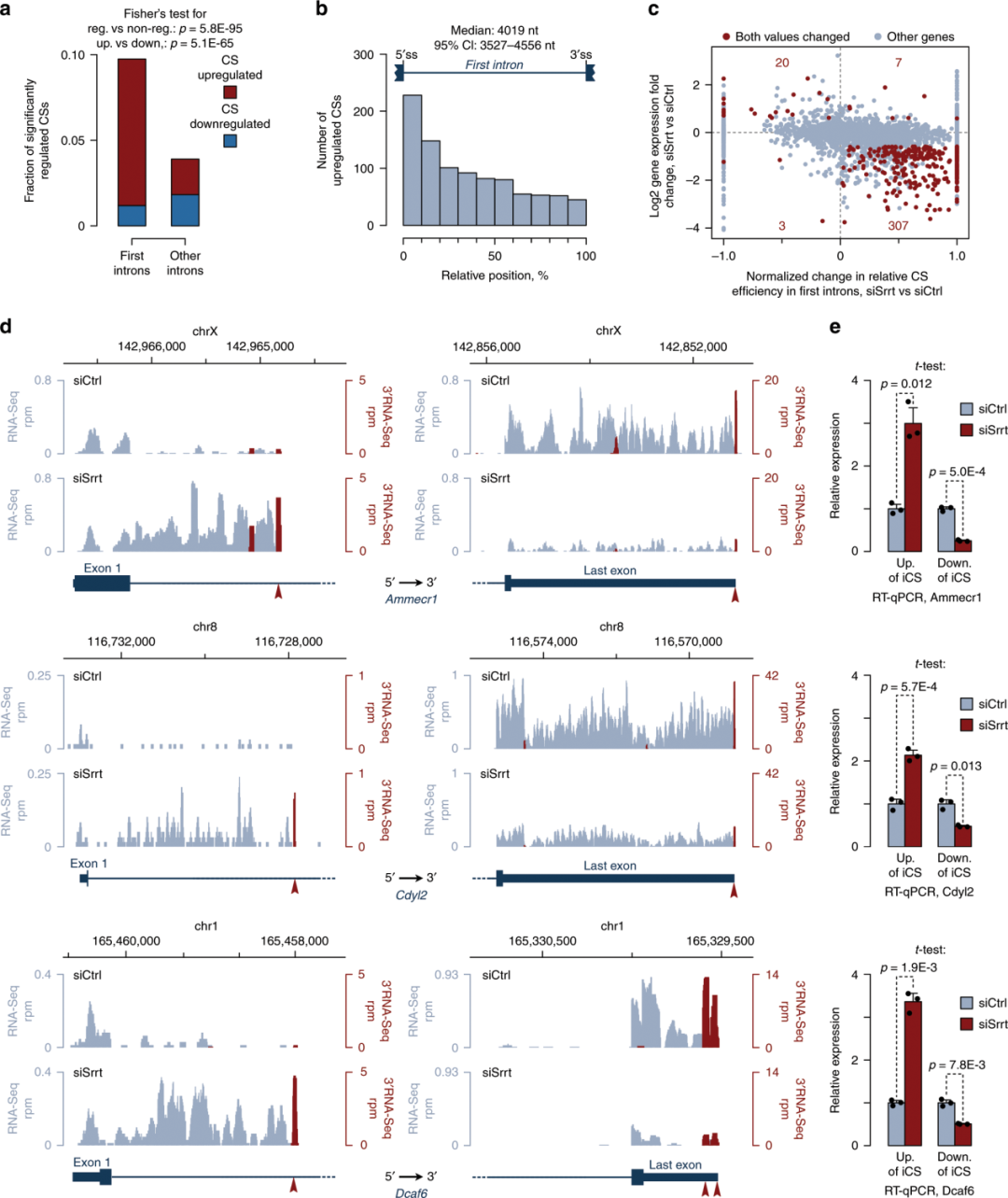 图4:Srrt阻止许多基因的第一个内含子中的切割/聚腺苷酸化。
图4:Srrt阻止许多基因的第一个内含子中的切割/聚腺苷酸化。

图5.内含子切割/聚腺苷酸化需要Ammecr1通过Srrt调节
Srrt介导的iCSs抑制依赖于CBC
为了研究CBC对Srrt依赖性抗终止活性的可能作用,作者敲除小鼠ESCs中的Ncbp1,并将此处理与siSrrt诱导的效果进行比较(图6a)。RNA-Seq和3'RNA-Seq分析显示,在整体基因表达变化和第一内含子CSs激活方面,siNcbp1-和siSrrt处理的样本之间存在显著的相关性(图6b,c)。为了测试Srrt和Ncbp1是否在同一途径中发挥作用,作者做了一个ESC细胞系,其中包含一个多西环素(Dox)诱导的抗小鼠特异性siSrrt的人Srrt转基因(Srrt -tg) (图6d)。要的是,SRRT-Tg足以挽救由siSrrt诱导而非siNcbp1诱导的Ammecr1转录本在第一个内含子的终止(图6e,f)。使用Ncbp1特异性抗体的RNA免疫沉淀(RIP)实验显示,siSrrt不会改变Ncbp1与(pre-)mRNA相互作用的能力(补充数据),这表明Ncbp1可能需要招募Srrt到其靶点,而不是其他途径。
根据以上数据,作者认为Srrt抑制第一个内含子的切割/聚腺苷酸化的能力取决于它与CBC的相互作用。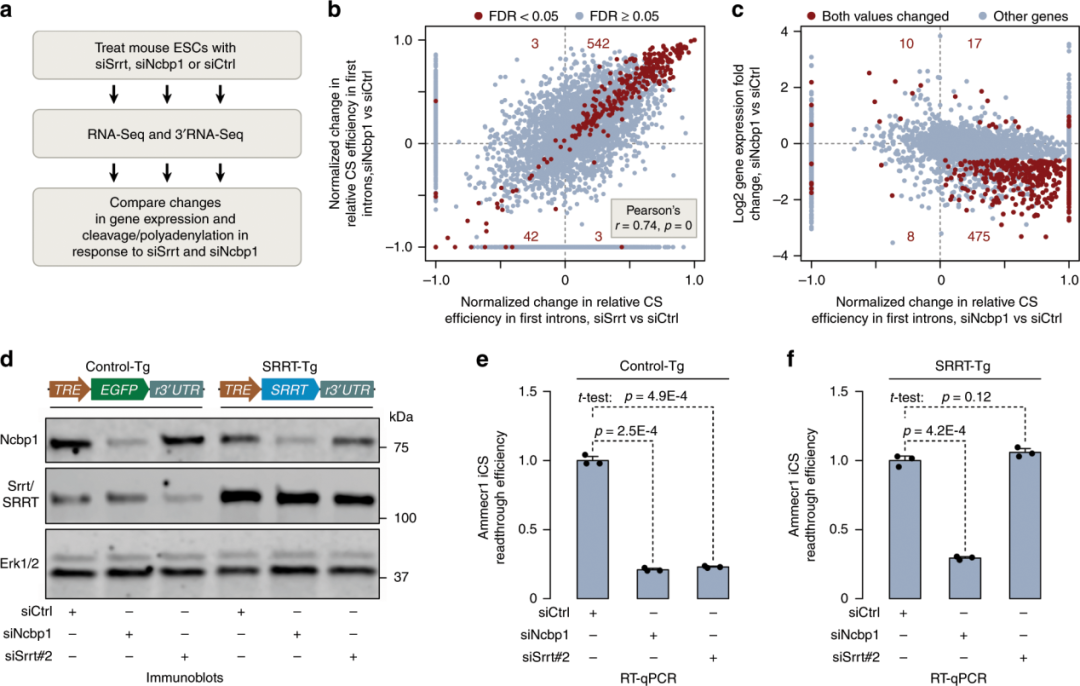
图6. srrt介导的iCSs抑制依赖于CBC
Srrt促进U1与受调控的iCS上游序列的结合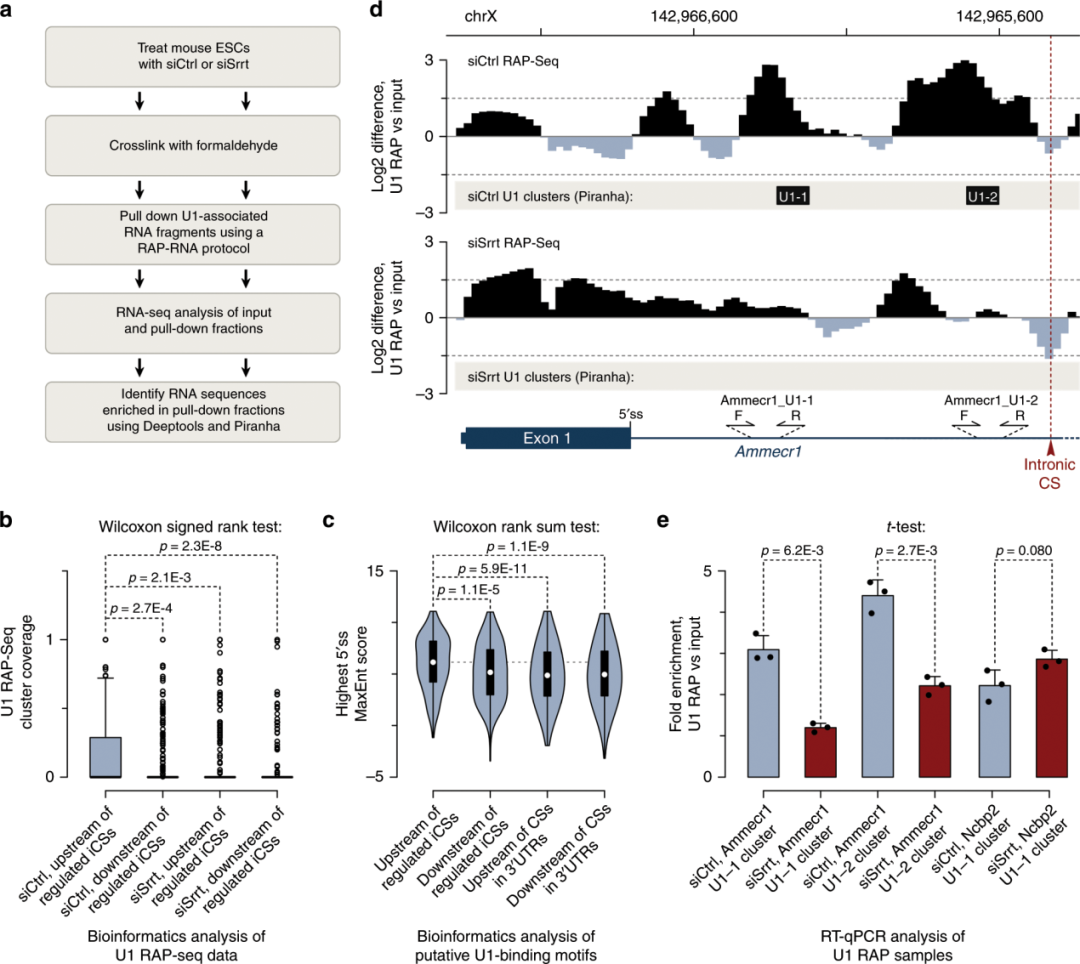
图7. Srrt促进U1与CSs的第一个内含子上游序列的结合
Srrt招募的U1可以促进远端抑制(telescripting)
为直接测试U1对iCSs的作用,作者用特异性AMO处理ESCs(图8a)。与对照(amoCtrl)或针对另一剪接体snRNA U2沉默处理(amoU2)的样品相比,amoU1 处理后Ammecr1 pre-mRNA第一个内含子中过早裂解/聚腺苷酸化的效率显著降低。amoU1的作用明显强于amoU2表明,Srrt刺激的U1 snRNP募集可以通过进远端抑制而不是剪接体组装途径抑制iCS。
为为了验证这一假设,我们将Ammecr1基因的外显子1-内含子1连接和srrt调节的iCS区域与包含组成型CS的重组3'UTR融合,构建了一个迷你基因(minigene)(图8b)。由于它缺乏功能性的3's,因此该基因结构使作者能够在没有pre-mRNA剪接的情况下进行远端抑制分析。minigene在用siSrrt或siControl预处理的ESC中表达,并通过RT-qPCR分析Ammecr1 iCS的使用情况(图8c)。概述内源性Ammecr1 pre-mRNA的行为,minigene来源的转录本显示在siCtrl中比siSrrt样品中更高效的iCS读通(图8c)。
5’ss突变,即U1结合启动内源性Ammecr1转录本剪接的位点, siSrrt对minigene的应答无影响(图8c)。然而,当我们突变另外三个预测与U1相互作用的位置时,无论Srrt表达水平如何,minigene在iCS处终止(图8c)。另外,删除iCS之前的PAS六聚体(ΔPAS)导致了一个组成型的通读表型(图8c)。
这些结果证实了Srrt可以通过u1依赖的远端抑制机制阻断内含子的切割/聚腺苷酸化。
之前的研究显示CBC可以促进U1募集到cap-近端内含子,而这种snRNP反过来可以通过telescripting拮抗切割/聚腺苷酸化。为了评估这些机制的可能作用,作者使用RNA反义链纯化测序(RAP-seq)对甲醛固定的ESCs进行测序,并绘制U1结合位点(图7a)。
尽管siCtrl-和siSrrt处理的ESCs表现出大体相似的U1结合曲线(补充材料),但在siCtrl中Srrt调节的iCSs上游有一个可识别的U1峰,而siSrrt样品则没有(补充材料)。支持该观点的是,使用先前描述的方法推导的U1簇的发生率在被Srrt抑制的iCS上游的250 nt窗口中比在siCtrl处理的细胞中大小相似的下游窗口中要高得多 (图7b)。这与iCSs上游相对较强的u1结合基序富集相一致,而在相同基因的3'UTRs中,其下游位置和毗邻CSs的250- nt窗口相对较强(图7c)。重要的是,Srrt敲降导致受调控的iCSs上游U1簇的覆盖率显著下降(图7b)。上述效应在Srrt的个别靶标中也可检测到。例如,两个突出的U1 RAP-seq峰在Ammecr1基因第一个内含子的5 'ss和强srrt抑制的CSs在siCtrl样品中显著富集,而siSrrt处理的样本则没有(图7d)。RT-qPCR分析下拉和输入片段证实,Srrt敲除显著降低了U1与对应的内含子位置的结合(图7e)。相比之下,非Srrt调控的控制基因Ncbp2第一内含子中U1的占据在siCtrl和siSrrt样本中没有显著差异(图7e)。
这些数据表明,Srrt促进受调控的CSs在第一个内含子上游对U1招募,而不是实质性地改变小鼠ESCs中snRNP的整体活性。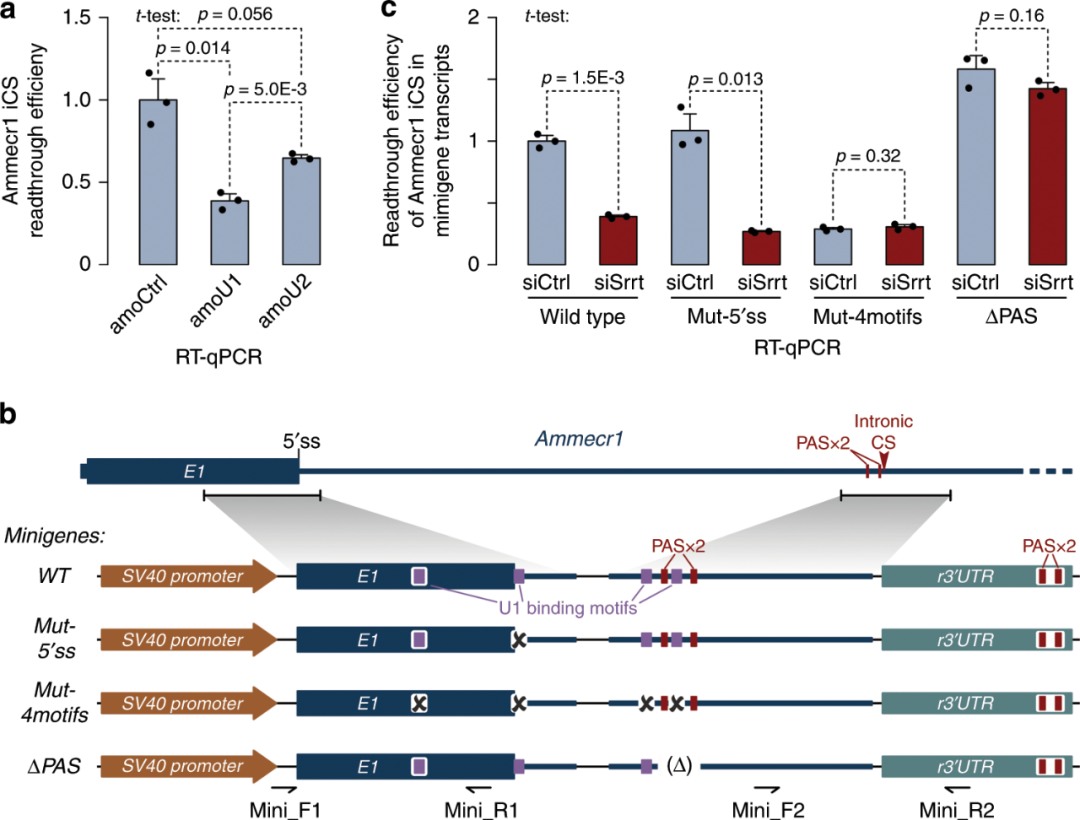
图8. srrt介导的Ammecr1 iCS的读取依赖于远端抑制
许多iCS是由于逆转录转座而出现
数据表明,ESCs中大量活性基因的高效转录依赖于Srrt丰度。为了理解这一调控的进化机制,作者针对受Srrt调控的iCS上游40nt和下游10nt界限的50nt窗口检查了物种间保守分数(图9a)。这些序列的一小部分(39.6%)显示出可检测到的保守性(PhastCons平均得分≥0.1)。包括Ammecr1,Cdyl2和Dcaf6,它们的iCS相关PAS六聚体存在于多个哺乳动物物种中(补充材料)。
大多数Srrt调控序列(60.4%)的保守性很差或根本不保守(平均PhastCons得分<0.1)。由于RTEs提供了种间多样性重要来源,作者想知道,小鼠/啮齿动物特异的iCSs是否是相对较新的逆转录转座事件的结果。值得注意的是,RTE密度图显示这些元素在Srrt抑制的iCSs紧挨上游序列的正义链方向有一个显著的峰值(图9b)。相反,在该区域中反义链RTE序列被耗尽(图9b)。
iCS相关的有义链峰宽约200 nt,表明它可能是由相对较短的RTE所主导(图9b)。事实上,终止于iCS(±50nt)附近的大多数正义链RTEs属于短散分布的核元件(SINEs)组。尽管有一些长散布的核元件(LINEs)和长末端重复序列(LTRs)也检测到(图9c)。总体而言,所有受调节的iCS的31.2%与有义链RTE的3'末端相关。
与iCS相关的B2 SINEs存在于一些基因中,例如在编码激活素受体Acvr1b(图1g),以及WNT通路调节因子Ankrd6/ Diversin,唐氏综合症关键区域蛋白Dscr3和热休克蛋白相关因子Hspbap1(图9d)。在LINE重复末端出现iCS的基因包括编码锚蛋白重复序列和SOCS框蛋白Asb3的基因,以及与ESC中未甲基化的DNA相互作用的调节复合物的成分Zbtb25(图9e)。在许多情况下,iCS之前的PAS六聚体与亲本RTEs中的相应元素匹配(图9d,e)。
发生在有义链RTE的3'末端的iCS保守性明显低于其他的iCS(图10a),这表明相应的RTE序列可能是相对近期跳跃的结果。事实上,与由第一内含子的所有义或反义重复或小鼠基因组中发现的全部重复组成的对照组相比,iCs相关重复序列与主拷贝的分歧更小(图10b)。
无论其iCS的RTE关联状态如何,所有Srrt调控的第一内含子都比非调控的第一或无第一内含子具有更高的RTE衍生序列密度(图10c)。我们还观察到所有内含子中RTEs的反义取向都有强烈的偏倚(图10c),这表明,以正义链为导向的RTEs可能比它们的反义链对应物更具破坏性,因此受到更强的净化选择。
作者的结论是,除了控制进化保守事件外,Srrt可能抑制逆转录的转位导致的有害iCSs的出现。
图9. 受调控的iCS通常是由于逆转录转座而出现的
Srrt靶基因往往具有长富含RTE的第一内含子
远端抑制对长转录本的生产至关重要。有趣的是,我们发现在全基因组范围内,RTE密度与第一内含子的整体大小之间存在相关性(图10d)。与增加的RTE负荷相一致,与对照组相比,Srrt依赖性基因的第一个内含子往往明显更长(图10e)。
为了查明第一个内含子的长度是否可以很好地预测Srrt依赖性,作者绘制了对照处理的ESC中基因的平均RPKM值,根据它们的第一内含子的长度分别分为:短,中和长(图10f)。即使Srrt正常,第一内含子较长的基因在ESCs中倾向于低水平表达。在第一个内含子中一个或多个AATAAA六聚体的存在与每个类别中平均表达的降低有关,但是这种影响在统计学上并不显着(图10f)。值得注意的是,作为siSrrt处理的响应,第一个内含子的长度与基因表达正相关,而AATAAA抑制基因的表达(图10g)。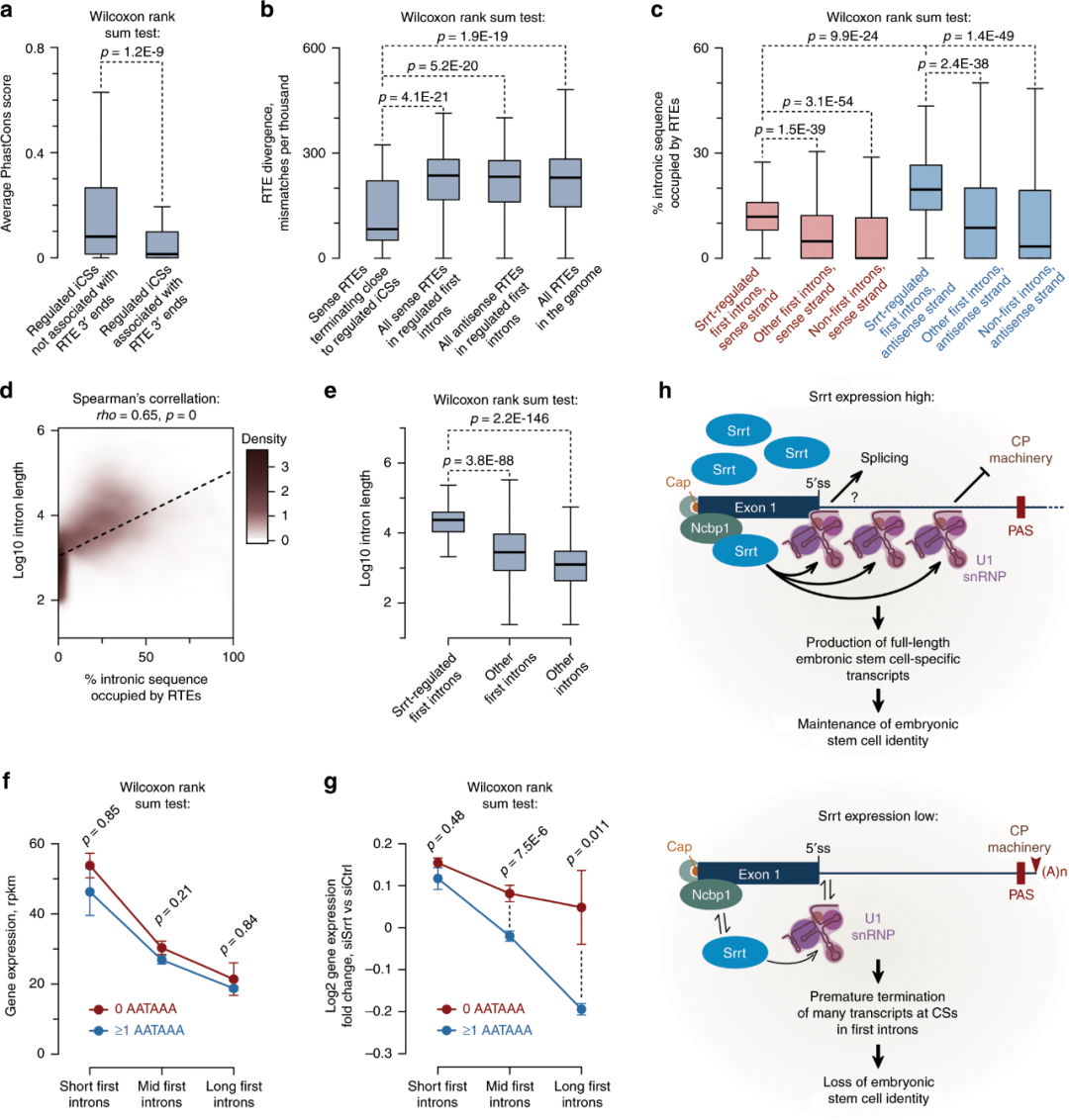
图10. 周期性的逆转录转位可能增加基因对Srrt的依赖性
参考文献:
Kainov, Y.A., Makeyev, E.V. A transcriptome-wide antitermination mechanism sustaining identity of embryonic stem cells.Nat Commun 11,361 (2020). https://doi.org/10.1038/s41467-019-14204-z